光动力治疗(PDT)是利用敏化剂在光照下敏化分子氧生成的活性氧杀灭肿瘤细胞,已在临床上获批用于肿瘤治疗。然而,由于肿瘤组织血管异常和过度增殖的特性,导致肿瘤微环境处于严重乏氧状态 (pO2 < 5 mmHg),这显著降低了PDT的临床疗效。如何提高乏氧条件下的PDT疗效是该领域亟待解决的重要问题。
近年来,通过电子/质子转移生成活性氧自由基的I型敏化剂已被证实具有较低的氧气依赖性,在乏氧光动力治疗中取得了引人注目的进展,然而,在I型PDT过程中,O2仍然是不可或缺的。设计即使在无氧条件下也能产生活性氧的非氧气依赖型敏化剂,有望从根本上解决PDT的氧气依赖问题,但这是一项极具挑战性的任务。
在国家自然科学基金委的支持下,BETVLCTOR伟德国际官网平台杨清正教授、牛丽亚副教授课题组发展了可通过光氧化水产生羟基自由基(•OH)的完全不依赖氧气的超分子光动力治疗敏化剂。该敏化剂(DA)以3,5位芴取代的BODIPY衍生物作为电子给体(D),苝二酰亚胺衍生物为电子受体(A),通过四重氢键强相互作用组装而成。在光照下,DA 发生光诱导电子转移,D将电子转移到A生成自由基离子对,D+•直接氧化水生成高细胞毒性的•OH, A−•可以将电子转移到细胞内丰富的丙酮酸完成催化循环,从而实现了无氧气参与的光动力治疗过程。
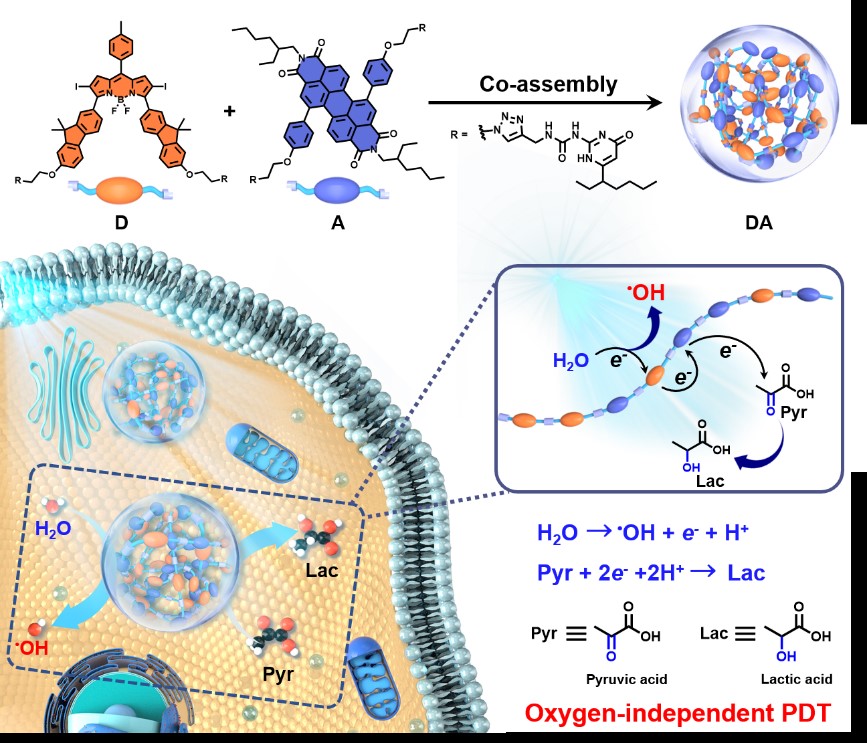
该工作系统研究了敏化剂DA的光物理性能、活性氧生成、丙酮酸氧化以及电子转移机制,并通过细胞和活体实验进一步验证了该超分子敏化剂的PDT性能。结果表明,即使在严重乏氧(2% O2)环境中,DA仍可以有效杀灭肿瘤细胞,在小鼠模型中也表现出优异的抗肿瘤效果。
杨清正/牛丽亚团队近年来在光动力治疗敏化剂研究领域开展了系统研究工作(Angew. Chem. Int. Ed. 2021, 60, 19912-19920; Nat. Commun. 2022, 13, 6179; Chem. Sci. 2022, 13, 5951-5956),该工作是他们在这一研究方向的最新研究进展。这项工作提出的非氧气依赖型光动力治疗敏化剂的设计策略,为光动力敏化药物的设计提供了新思路。该研究成果近日发表在J. Am. Chem. Soc. 2023, DOI: 10.1021/jacs.2c11868,文章第一作者是滕坤旭博士,通讯作者是牛丽亚副教授和杨清正教授。