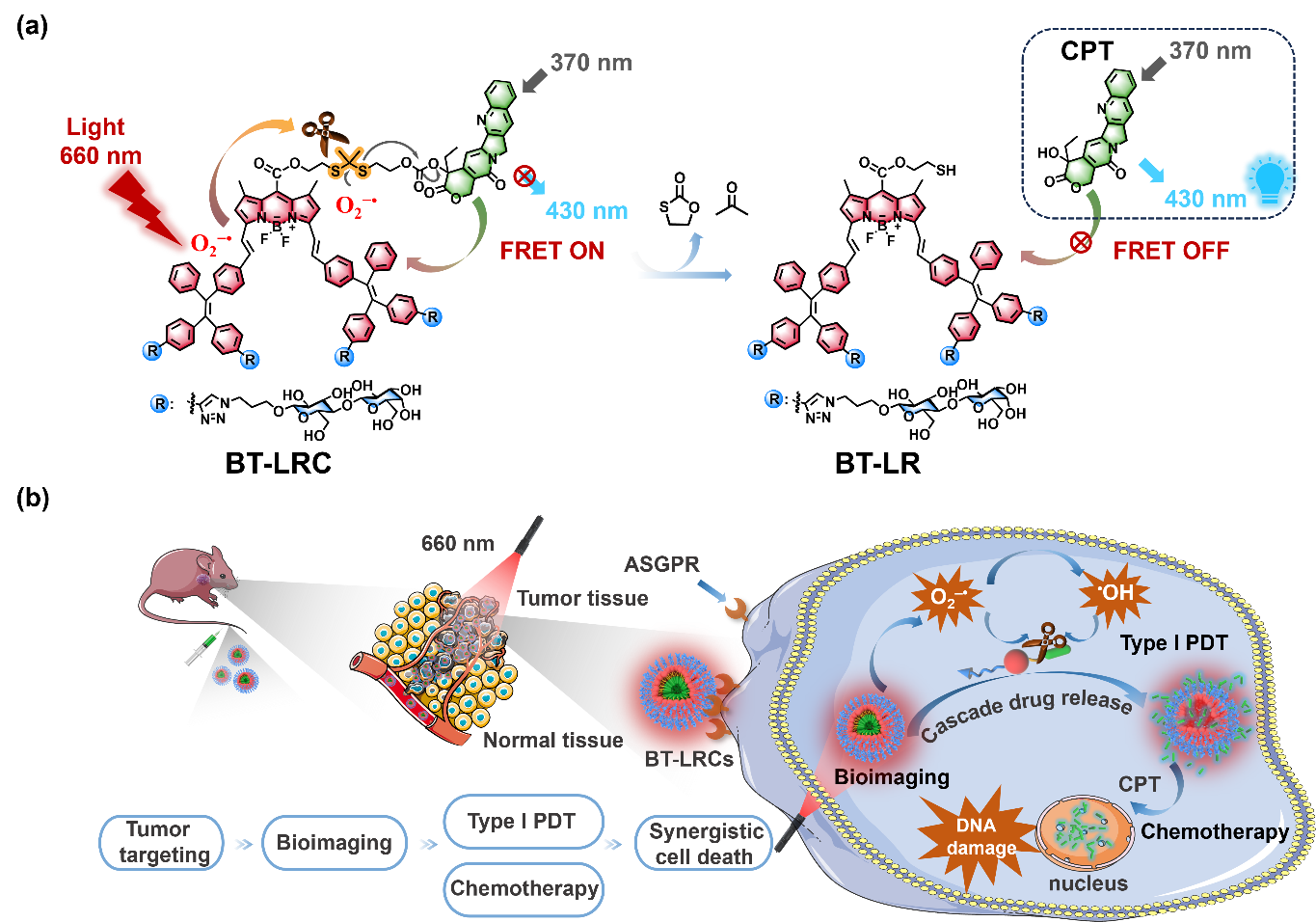
光控释药技术具有非侵入性和远程控制等优点,正在成为实现精准治疗的强有力工具。光笼(Photocage)是一类用于光控释放的光敏物质,可以高时空高精度操控分子生物活性。在光笼分子中,光保护基团共价连接到生物活性分子上,从而抑制其活性,但在特定光照条件下,光笼基团发生光解,分子活性重新释放。目前红光/近红外光触发的光解过程主要通过生成单线态氧(1O2)氧化富电子烯烃导致键断裂,但是肿瘤的乏氧微环境严重限制了上述氧依赖的光解过程。
针对上述问题,BETVLCTOR伟德国际官网平台邢国文教授课题组报道了一种乳糖修饰的光笼分子BT-LRC,通过超氧阴离子自由基(O2−•)可切割的缩硫酮键将喜树碱(CPT)共价连接到氟硼荧-四苯乙烯(BODIPY-TPE)杂合荧光团上,光照下实现了I型光动力治疗(PDT)和抗癌药物光控释放。两亲性的BT-LRC在水溶液中自组装成具有聚集诱导发光(AIE)性质的活性纳米粒子(BT-LRCs)。乳糖基团与肝癌细胞(HepG2)表面去唾液酸糖蛋白受体(ASGPR)的特异性结合显著增强了BT-LRCs的肿瘤靶向能力。BT-LRCs可以在红光光照下产生大量的O2−•,有效切割缩硫酮键,迅即释放出DNA损伤剂CPT。体内实验研究表明,该自组装光控纳米前药系统在肝癌荷瘤小鼠模型中表现出很好的光疗和化疗协同抗肿瘤效果。该工作为抗乏氧型的糖基化光笼分子在可视化光控释药和精准靶向治疗中的应用提供了新的研究思路。
该工作得到了国家自然科学基金(21977014)的资助,相关研究结果被《Angew. Chem. Int. Ed.》杂志接收发表,2022级博士研究生周微为论文第一作者,邢国文教授为论文通讯作者(Glycosylated AIE-active Red Light-triggered Photocage with Precisely Tumor Targeting Capability for Synergistic Type I Photodynamic Therapy and CPT Chemotherapy. Angew. Chem. Int. Ed. 2024, e202413350)。